 Imagens Getty
Imagens GettyO primeiro medicamento para retardar a progressão da doença de Alzheimer precoce não estará disponível no NHS em Inglaterra porque os benefícios são “demasiado pequenos para justificar o custo”, de acordo com a organização de avaliação de saúde NICE.
Lecanemab foi aprovado pela Agência de Medicamentos do Reino Unido (MHRA), o que significa que pode ser prescrito de forma privada.
Em tentativasmostraram que a droga retardou o declínio cognitivo em pacientes com doença de Alzheimer em estágio inicial em cerca de um quarto durante um período de 18 meses.
Mas no projeto de diretrizesO NICE disse que o tratamento envolveu custos significativos, incluindo monitoramento intensivo de efeitos colaterais e internações quinzenais dos pacientes.
A Alzheimer’s Research UK chamou isso de “momento agridoce”.
“A aprovação do lecanemab é um marco, mas a decisão do NICE de não aprová-lo para o NHS é profundamente decepcionante”, disse o chefe de política David Thomas.
Dr. Samantha Roberts, executiva-chefe do NICE, disse que a organização considerou cuidadosamente as evidências disponíveis, incluindo benefícios para os cuidadores, mas só poderia recomendar tratamentos que proporcionassem “bom valor para o contribuinte”.
“O lecanemab retarda a progressão da doença de Alzheimer leve a moderada em uma média de quatro a seis meses. No entanto, este benefício não é suficiente para justificar o custo adicional para o NHS”, disse Helen Knight, chefe de avaliação de medicamentos do NICE.
Cerca de 70.000 adultos na Inglaterra seriam elegíveis para o tratamento com lecanemab.
O País de Gales e a Irlanda do Norte seguem frequentemente as orientações médicas da Inglaterra.
O painel que avalia os medicamentos recentemente aprovados na Escócia ainda não tomou uma decisão sobre o valor do medicamento.
Acesso limitado
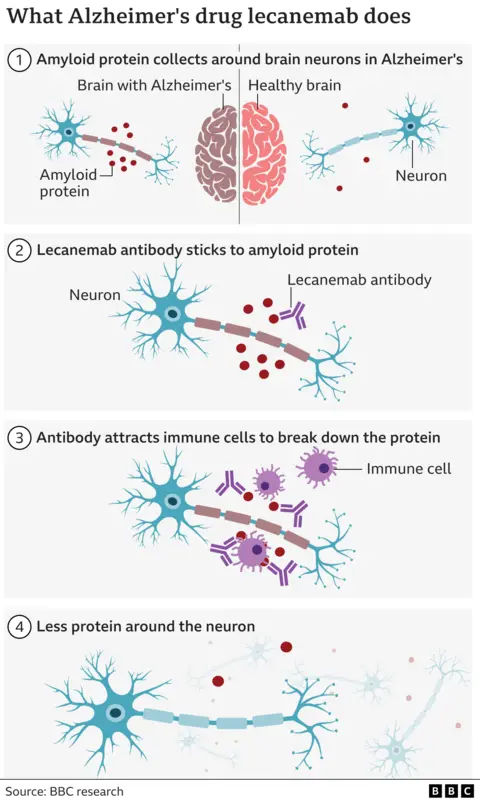
Lecanemab atua eliminando uma proteína indesejada chamada amiloide, que se acumula no cérebro de pacientes com Alzheimer. É administrado por perfusão intravenosa a cada duas semanas.
Os investigadores da doença de Alzheimer descreveram os resultados do estudo como históricos porque nenhum dos medicamentos anteriores tinha sido capaz de demonstrar de forma convincente que o mecanismo subjacente da doença poderia ser retardado.
No entanto, tem havido preocupações sobre a ocorrência comum das chamadas anomalias de imagem relacionadas com a amilóide (ARIA), que aparecem em exames de ressonância magnética, tais como pequenas hemorragias cerebrais e inchaço temporário.
Embora a maioria dos casos nos estudos fosse leve ou não apresentasse sintomas, alguns casos necessitaram de tratamento hospitalar.
Nenhum preço do medicamento foi anunciado publicamente no Reino Unido, mas nos EUA custa cerca de £ 20.000 por paciente por ano.
Fiona Carragher, da Sociedade de Alzheimer, disse à BBC News que a decisão “levaria à incerteza e à confusão para quase um milhão de pessoas que vivem com demência”.
Embora a MHRA tenha aprovado o medicamento no Reino Unido, impôs algumas restrições aos pacientes que podem recebê-lo devido ao risco de efeitos colaterais.
Pessoas que carregam duas cópias do gene da apolipoproteína E4 (ApoE4) (cerca de 15% da população) não são elegíveis, nem pessoas que tomam anticoagulantes.
O Lecanemab, cuja marca é Leqembi, já está aprovado nos EUA, Japão e China.
Mas no mês passado a Agência Europeia de Medicamentos (EMA) uma licença recusada, Ele disse que o benefício foi pequeno e não superou o risco de efeitos colaterais graves, principalmente sangramento e inchaço no cérebro.
Para avaliar se um paciente é adequado para lecanemab, o nível de amiloide no cérebro deve ser medido. Isso é feito por meio de uma tomografia cerebral PET ou de uma punção lombar.
Nenhum destes procedimentos é uma ferramenta de diagnóstico padrão para pacientes com suspeita de demência e são utilizados apenas em contextos de investigação. Estima-se que apenas 2% dos pacientes com Alzheimer têm acesso a um destes métodos de diagnóstico “padrão ouro”.
“Anos Maravilhosos”

Mavis Guinn, 90 anos, é uma das poucas dezenas de pessoas no Reino Unido que receberam lecanemab como parte de um ensaio clínico.
Seu marido, Rodney, diz que isso permitiu que Mavis mantivesse sua personalidade.
“Passamos anos maravilhosos e ótimos momentos desde que você tomou aquele remédio”, ele diz a ela.
“E também sou grata por isso, meu Deus, porque faz diferença na sua vida, não é?”, diz Mavis.
Ela recebe o medicamento por infusão a cada duas semanas, mas sua memória de curto prazo permanece gravemente prejudicada.
Os benefícios do lecanemab são modestos – alguns até afirmam que são quase imperceptíveis. Depois, há os possíveis efeitos colaterais.
Ainda assim, muitos especialistas consideram este um momento crucial que mostra que a doença de Alzheimer não é imparável. A doença de Alzheimer é a forma mais comum de demência e a principal causa de morte no Reino Unido.
A revista Panorama da BBC acompanhou pacientes que tomavam lecanemab e outro novo medicamento, o donanemab.
Em o programa, Num programa transmitido no início deste ano, a professora Cath Mummery, neurologista e chefe de ensaios clínicos do Centro de Pesquisa de Demência da University College London, disse que, embora os benefícios dos medicamentos fossem pequenos, eles representavam uma mudança de jogo.
“Pela primeira vez temos medicamentos que mostram que é possível mudar o curso da doença de Alzheimer, e isso é algo extraordinário.”











/cdn.vox-cdn.com/uploads/chorus_asset/file/25481481/windowsrecall.jpg?w=120&resize=120,86&ssl=1)